语:冠状动脉粥样硬化心脏(冠心病)是威胁人类健康的重要杀手之一,目前治疗冠心病的手段主要有三种:药物保守治疗、冠脉搭桥手术和经皮冠状动脉介入治疗(Percutaneous Coronary Intervention,PCI)。其中是介入治疗的一种重要手段,在医学影像设备的引导下,利用穿刺和导管技术将冠状动脉支架送至冠状动脉病变部位进行治疗,创伤小,见效快,因此成为目前临床上用来治疗冠心病的有效方法。
冠状动脉支架是一种由生物医用材料制成的网状支撑装置,在闭合状态下经导管送至冠状动脉病变部位,利用气囊扩张或自膨胀等方法展开,达到撑开狭窄的血管,恢复病变部位血流的目的。理想的冠状动脉支架需要具备以下基本性能:①足够的径向支撑力,能够有效支撑动脉血管壁,防止动脉血管壁的回弹,且支撑强度在支架圆周上均匀分布;②良好的轴向柔顺性,能够通过复杂弯曲血管,并具有良好的流体动力学相容性;③影像学可视性,能够在X 射线下可见,利于造影时的准确追踪;④较大的扩张比,使支架压握到足够小的尺寸并能够在靶病变部位扩张到预设尺寸,减少输送过程中对血管壁的损伤;⑤良好的生物相容性,不产生炎症和致敏反应,并且具有良好的抗凝血性,防止急性血栓形成和阻止内膜组织增生。
世界上第一例冠状动脉支架植入术于1987年被成功实施,拉开了冠状动脉支架时代的大幕, 自此, 冠脉支架先后经历了金属裸支架(Bare-metal Stent,BMS)、 药物洗脱支架(Drug Eluting Stent,DES)以及可降解 / 可吸收冠脉支架(Biodegradable/Bioabsorbable Stent,BDS)三个里程碑式的发展。
一、金属裸支架
冠脉支架的研发是为了提供力学支撑解决单纯球囊扩张引起的闭塞和再狭窄,因此一些力学性能优异的生物医用金属成为支架材料的首选,例如316L 不锈钢、镍钛合金、钴铬合金等等。 316L 不锈钢是医学中普遍应用的一种生物医用金属材料,其表面能够形成致密的氧化层,从而具有很好的抗腐蚀性,且其具有杨氏模量较大、屈服强度不大、材料柔顺性好等优点满足作为支架材料的基本要求。之后,其他合金材料被逐渐开发应用,使得冠脉支架以更细的小梁提供更强的径向支撑力、更好的X 射线可视性以及更优的支架顺应性。镍钛合金具有形状记忆效应,同时拥有良好的超弹性和生物相容性,也被广泛应用于冠脉支架。而钴铬合金作为支架材料,有更大的强度,更容易达到血管远端。
BMS 的临床试验结果显示,BMS 能够有效降低单纯球囊扩张的再狭窄率,对低危患者具有良好的安全性。然而,BMS 植入后早期可引起炎症反应,导致细胞黏附和增生、支架内血栓形成、形成伪内膜等。支架长期存留还可能造成血管慢性损伤、血管中层萎缩、动脉瘤形成以及反应性内膜增生,最终导致晚期血管再狭窄,总的再狭窄率仍然保持在15%~20%。通过结合药物治疗使用阿司匹林和血小板聚集抑制剂几乎消除了早期支架内血栓形成的风险,为解决支架内晚期再狭窄问题,新一代冠脉支架采用载药手段,将抑制组织增生的药物涂覆到金属裸支架表面,进一步降低再狭窄率。
二、药物洗脱支架
2001 年欧洲心脏学会上公布了有关RAVEL新型载药支架的研究结果,开启了DES 的新纪元。传统的DES 是在金属裸支架的基础上涂覆了一层载有抗凝血和/ 或抗组织细胞增殖的药物的高分子涂层,在血流的冲刷和溶解作用下,使药物不断的从支架表面释放,在以达到对抗支架内再狭窄的目的,并且促进PCI 在处理复杂病变时的应用和效果,目前药物洗脱支架已经成为临床应用的主要使用对象。
第一代DES 以Johnson 公司的Cypher 支架和Boston Scientific 的Taxus 支架为代表,采用不锈钢支架为平台,具有较好的X 射线可视性,但支架壁较厚使通过性受到限制。涂层材料为不可降解的高分子聚合物,在体内成惰性、非水解,其药物释放机制主要是扩散控制释放,药物释放速度由涂层厚度、药物扩散系数和支架表面积决定。其中Cypher 支架的三层涂层从里到外分别为聚对二甲苯粘结层,转载有雷帕霉素的聚乙烯/醋酸乙烯酯混合载药层,以及聚乙烯- 醋酸乙烯酯/ 醋酸乙烯酯控释涂层,Taxus 支架表面是单一的载有紫杉醇的三嵌段共聚物载药涂层[1,2]。
2
第二代DES 以美国Abbott Vascular 公司的Xience V 支架为和美国Medtronic 公司的Endeavor 支架为代表,采用了钴铬合金支架平台,相比第一代DES 的不锈钢支架平台,支架壁减薄,在保持较好的可视性的同时支架顺应性提高,同时研发新的药物,如Xience V 支架上涂覆药物为依维莫司(西罗莫司的羟乙基衍生物),Endeavor支架则涂覆佐罗莫司药物,但载药涂层仍是不可降解高分子。
随着DES 的不断应用,晚期和极晚期支架内血栓形成逐渐表现出来,病理研究发现其主要机制是由于DES 的多聚无涂层作为过敏原引起的过敏反应致使血管内膜愈合延迟、晚期支架贴壁不良等,药物在抑制细胞增殖的同时也阻止了损伤血管内皮修复。而单纯的依靠支架表面微槽工艺搭载药物无法做到对药物的程控释放,相对稳定能有效控制药物释放的载体涂层现阶段还是必须的,因此第三代药物洗脱支架采用生物可降解的高分子材料作为新型的载药涂层[3,4]。
3
可降解高分子涂层在体内通过水解或者酶解反应最终降解为小分子,最终转化为水和二氧化碳,排出体外,例如左旋聚乳酸、聚羟基乙酸、聚己内酯等。早期采用这项技术的以BioMatrix(美国Biosensors 公司)、NOBORI(日本Terumo 公司)和Axxess(美国Devax)支架为代表。另有美国Johnson and Johnson 公司的NEVO 西罗莫司支架以可降解的乳酸- 羟基乙酸共聚物(PLGA)为载药涂层。临床研究结果已证实,NEVO 支架的晚期官腔丢失显著小于Taxus 支架。至今临床上主流DES 均以PLGA 为载药聚合物涂层。
随着DES 的临床应用增加,发现虽然DES能够通过抑制血管内膜过度增生,进一步减少再狭窄,然而DES 延迟内膜愈合,导致慢性炎症,增加晚期和极晚期支架内血栓形成。而支架在完成预防血管负性重构及释放抑制血管内膜增生的药物的功能之后(一般认为在6 个月以后),其在血管内持久存在已无必要反而有潜在危害,在此背景下,可降解冠脉支架或成为生物可吸收支架应运而生。
四、生物可降解支架/ 生物可吸收支架
理想可降解支架是植入后提供了力学的开启支撑并阻止早期的动脉血管回弹(1~6 个月),当血管组织在支架扩张压力下重建后(6~12 个月),支架逐渐降解,最终完全消失(12~24 个月)只留下痊愈的动脉血管[5]。目前生物可降解支架按照机体材料分类主要分为可吸收高分子支架和可降解金属支架两大类。
可吸收高分子支架
可降解高分子材料在药物洗脱支架中已经应用于载药涂层,在体内经过一系列水解、酶解反应等生成小分子链,通过三磷酸循环,最终以二氧化碳和水的形式排出。当用作支架材料时,高分子材料的强度,以及在足够径向力作用下的扩张能力,是支架成功展开和避免早期回弹的必备条件[6]。
现阶段开发应用的较大的产品有:日本Igaki Medical Planning 公司研发的Igaki-Tamai(PLLA)支架,美国Abbott Vascular 公司的BVS(PLLA)血管支架,Reva Medical 公司研发的REVA(PC)支架,以及我国山东华南生物科技有限公司的Xinsorb 支架(图1)。
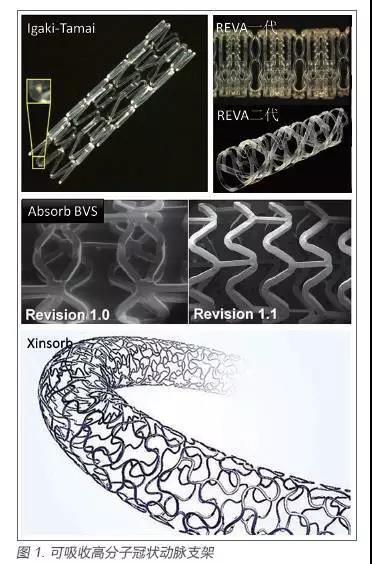
Igaki-Tamai 支架是一种可降解的PLLA 单纺丝制成的之字螺旋形结构的支架,这种结构突破了之前的编织结构,减少了植入时对血管壁的损伤(Igdu-Tamai stent ;Igaki Medical Planning Co.,Ltd., Kyoto,Japan)。1998 年开始临床试验,即时造影效果佳,植入冠脉血管后3 年内消失[7-10]。目前已经有10 年的随访结果,是迄今为止植入时间最长的可降解支架植入病例。靶病变血运重建率为28%,期间发生2 例确定的血栓事件,总体安全性和疗效良好,但由于支架释放过程复杂,需要80˚C 的造影剂输送,可能会造成动脉壁坏死、内膜过度增生血小板黏附等,因此难以在临床上广泛应用,新一代的Igaki-Tamai 支架改良为球囊扩张方式,正在研发中[11]。
Absorb BVS(Abbott Vascular,Santa Clara,Calif)支架是第一款药物洗脱的可降解支架,全称为生物可降解依维莫司药物洗脱聚乳酸支架(Bioabsorbable Everolimus–Eluting Stent,BVS),采用PLLA 作为支撑骨架,覆盖载有依维莫司药物的PDLLA 涂层如图3 所示,控制药物缓慢释放,抑制细胞增殖[12-14]。虽然早期临床试验初步证实了其应用的安全性,并在2016 年取得了美国FDA 的上市批准[15-16]。ABSORB III 研究是迄今为止评估Absorb BVS 长期效果的最大规模、随机、对照临床试验,研究共纳入193 个中心的2 008例患者,(按2:1 比例随机接受Absorb 支架(n=1322)或金属支架(n=686))。但最新消息在2017年第66 届美国心脏病学会上发布了ABSORB III的研究结果,发现两年的随访:靶病变失败风险显著高于金属支架组(10.9% vs 7.8%,p=0.03), Absorb BVS 的患者靶血管心肌梗死事件率显著高于金属支架组(7.3% vs 4.9%,p=0.04),AbsorbBVS 的患者确定和极有可能的支架血栓率为1.9%,是金属支架组的2 倍以上(金属支架组为0.8%)。经过与FDA 和该研究的研究者进行商议,ABSORB III/IV 研究的标志性终点——TLF观察时间从最初方案的1~5 年修改为3~7 年(或3~10 年)。
REVA(Reva Medical Inc,San Diego,Calif)是一种有高的径向强度和极小的回弹的聚碳酸酯支架,利用标准的球囊来扩张,采用滑扣设计,依靠各部分的滑动和锁定来扩张,从而减少支架在展开时发生变形时强度削弱。采用碘提供自身不透射线[12-13,17]。支架在植入30d 之后开始降解,12 个月后完可降解。但是发现高分子的脆化导致的靶病变处力学性能下降,而使靶病变血运重建速率(66.7%)比预期的高。
Xinsorb 支架(山东华安生物科技有限公司)和Enovaʼs™ 支架(北京乐普公司)是中国自主研制的生物可降解药物洗脱支架[18-20],目前已完成1200 例临床试验;Firesorb™(上海微创公司)已完成30 例临床探索性试验。
2
可降解金属支架
可降解高分子材料的固有强度比金属或合金要低,因此高分子支架厚度和体积比金属支架的大很多以获得足够的径向支撑力,且其射线可见性差也限制了其临床应用。可降解金属支架力学强度高、可视性好,作为血管支架具有很强的优势。
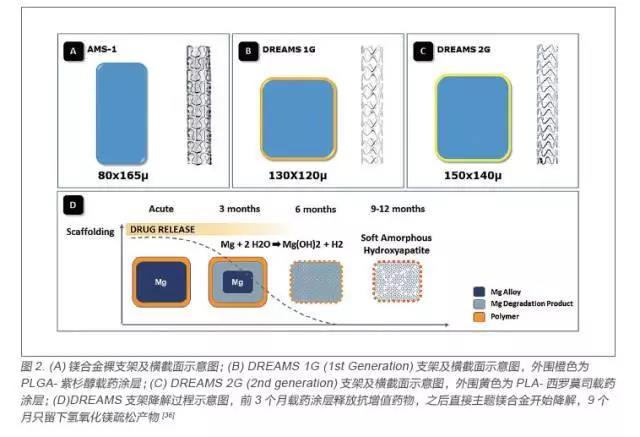
镁是人体的必需元素,具有多种生理功能,与生命的维持、身体的健康有着极其密切的关系,因此可降解冠脉镁合金支架研发处于可降解金属支架的领先水平,以德国Biotronik 公司的镁合金支架为代表, 前后经历了AMS、DREAMS 1G(drug-eluting absorbable metal scaffold 1 generation)和DREAMS 2G(drug-eluting absorbable metalscaffold 2 generation)三代支架(图2),支架基体采用WE43 镁合金材料[21]。AMS 为镁合金裸支架,经过PROGRESS 临床实验显示支架具有良好的安全性,且在新生儿体内植入两个AMS支架后,新生儿血清镁含量处于正常水平,且不需要进行二次手术,但是降解速度太快径向支撑力不足导致晚期管腔丢失现象严重,因此在该基础上对镁合金裸支架的成分和构型进行了更新,加粗了骨架尺寸,添加了一层载有紫杉醇药物的可降解PLGA 高分子涂层,从而增强了支架支撑力,减少内膜增生以及降低降解速率,研发出了DREAMS 1G[22-24]。
BIOSOLVE-1 临床试验证实DREAMS 1G 支架在6 个月和12 个月的支架内晚期管腔丢失有较大改善,但是跟传统的药物洗脱支架还有一段距离[25]。进而支架进行了再一次升级,新一代DREAMS 2G 支架继续加粗,采用了高强度和更灵活的结构设计,具有更好的顺应性和径向支撑力,药物也换成了比紫杉醇更好的抗内膜增生效果的雷帕霉素。BIOSOLVE-2 临床试验结果表明晚期管腔丢失进一步改善[26]。2016 年6 月,DREAMS 2G 支架获得CE 认证。
我国的镁合金冠脉支架也是研发热点,多家企业和研究单位正在进行相关实验,其中以江苏沣沅医疗器械有限公司的Mg-Zn-Y-Nd 可降解镁合金冠脉支架正在进行临床研究前的注册检验[27], 上海交通大学的JDBM(Mg–2.5Nd–0.2Zn–0.4Zr)[28-31] 和中国科学院金属所的AZ31 镁合金支架等[32-35] 也进行了大量的体内外相关实验研究。
铁基和锌基可降解冠脉支架也在国内开展研究。
总结和展望
随着材料学、药学和生命科学的不断发展和进步,心血管支架系统也在不断地更新完善,支架基体向着更细更强和可降解的方向发展,药物也更加特异性,同时出现一些非主流支架体系如放射性支架、基因支架、内皮祖细胞捕获支架等等,以降低炎症反应和再狭窄的问题,最大程度上减少病人的痛苦。人们对于新一代的可降解支架给予了很高的期望,但还需要更多的循证医学证据,在未来一段时间内,DES 仍将是主流产品。
请登录后参与评论...
登录后参与讨论
提交评论